domingo, 7 de octubre de 2012
La controversia Fosfato-Arseniato finaliza/The Phosphate/Arsenic controvesy ends
Una diferencia de pocos grados en un ángulo de un enlace de hidrógeno evita que las bacterias absorban arseniato en vez de fosfato según un nuevo estudio publicado el 3 de octubre en Nature.
El arseniato es estructuralmente muy similar al fosfato, pero nuevas investigaciones muestra que algunas proteínas responsables de la incorporación de fosfato son incapaces de manejar el ligeramente más grande arseniato, que distorsiona un enlace de hidrógeno clave permitiendo que ciertas especies de bacterias crezcan en ambientes con elevado arseniato.
Los resultados "muestran como un guarda [proteína] mantiene al arseniato fuera [de bacterias], de forma que los niveles no se acumulan y las bacterias no tengan que preocuparse por los efectos tóxicos", según Ronald Viola, un químico de la Universidad de Toledo que no participó en la investigación.
El estudio acaba definitivamente con un artículo de Science de 2010, en el que investigadores de la NASA afirmaron haber descubierto una cepa de la bacteria Halomonas en el Lago Mono (California), que usaba arseniato en lugar de fosfato en el esqueleto de su ADN. El estudio organizó un enorme revuelo en la comunidad científica,generando muchas críticas. Los hallazgos fueron posteriormente refutados por varios estudios, aunque el artículo no ha sido retirado.
El nuevo trabajo proporciona una explicación mecanicista de cómo las bacterias del Lago Mono recolectan el suficiente fosfato de su entorno para crecer, a pesar de los altos niveles de arseniato en el agua. El fosfato es esencial para la vida, y forma parte de la molécula clave para la energía celular, el trifosfato de adenosina (ATP), y del esqueleto del ADN. Aunque el arseniato es similar en tamaño y estructura al fosfato, sus compuestos son mucho menos estables. Como resultado, si las enzimas incorporar arseniato en ATP, por ejemplo, se producirá en un ciclo "inútil", según explica el primer firmante del trabajo, Mikael Elias del Instituto de Ciencia Weizmann de Israel, puesto que la célula no obtiene energía a pesar de sus esfuerzos, ya que la molécula basada en arseniato se degrada rápidamente.
Después de que el polémico estudio polémico del pasado año afirmara refutar ese dogma, Elias y el líder del estudio, Daniel Tawfik, comenzaron a investigar las estrategias que utilizan las bacterias para evitar cometer ese error. Los investigadores pensaron en las proteínas fosfatadas (PBP o Protein-Bonded-Protein), que forman que forman parte de la cadena de transporte que las bacterias utilizan para incorporar fosfato del entorno. Clonaron PBPs procedentes de diferentes especies de bacterias, incluyendo Pseudomonas fluorescens, que mueren con niveles elevados de arseniato, y dos de GFAJ-1, la cepa tolerante al arseniato del Lago Mono. Comprobaron a continuación la capacidad de los diversos PBPs para discriminar entre el fosfato y arseniato, encontrando que la mayoría tenía una selectividad hacia el fosfato de 500 a 850 veces. Aún más impresionante, la PBP-2 de GFAJ-1 , que está sobre-regulada cuando hay poco fosfato, demostró ser 4.500 veces más selectiva para el fosfato que para el arseniato. Esta extremada selectividad es la que, presumiblemente, permite a la bacteria GFAJ-1 sobrevivir en condiciones de alto arseniato uniéndose solo al fosfato, por escaso que sea éste.
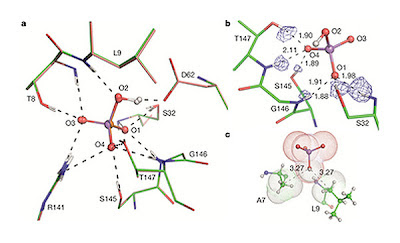
El siguiente paso fue descubrir cómo los PBPs distinguenr entre arseniato y fosfato. El arseniato es sólo un 4 por ciento aproximadamente más grande que el fosfato en volumen, lo cual es una de las razones por lo que algunas proteínas tienen dificultades para distinguir entre los dos. La cristalografía de rayos X demostró que el PBP de P. fluorescens unió las dos moléculas con sólo sutiles diferencias, que Elias no habría percibido si sus datos ristalográficos no hubieran tenido una resolución de menos de un angstrom. Pero los investigadores pudieron ver en las detalladas imágenes que, en comparación con el fosfato, el arseniato dejó uno de los 12 enlaces de hidrógeno de la zona de unión fuera de alineamiento. "Los ángulos de enlace son muy importantes en los enlaces de hidrógeno " según Elías, que añadió que esta estrategia para discriminar entre los iones fosfato y arseniato "no tiene precedentes que yo sepa."
Según Ken Scott, un biólogo molecular de la Universidad de Auckland (Nueva Zelanda) que no participó en la investigación, "las diferencias en los ángulos de enlace son realmente muy pequeñas, pero para una buena actividad catalítica, sabemos que los ángulos de enlace deben estar exquisitamente alineados, y esto parece ser lo mismo para las proteínas de unión".
Según Elias, las implicaciones de esta investigación son de dos tipos. Primero y por supuesto, complementa lo que se conoce acerca de cómo las bacterias resisten la toxicidad al arseniato: "Si el veneno está fuera, la primer línea de resistencia consiste en no introducirlo". En segundo lugar, Elías está entusiasmado con la posibilidad de aplicar esta estrategia discriminadora a la biología sintética, lo que tal vez permita a los científicos evitar los efectos secundarios diseñando fármacos con alta selectividad de unión a los objetivos adecuados.
Además, este trabajo, así como la serie de estudios que aportaron evidencias que contradecían el artículo inicial de Science sobre las bacterias del Lago Mono, demuestra que "la ciencia está funcionando como se supone que debe hacerlo", dijo Viola. "Haces una observación, construyes a una hipótesis, y la compruebas".
A few degrees difference in a single hydrogen bond angle prevents bacteria from importing arsenate in place of phosphate, according to a new study published (October 3) in Nature. Arsenate is structurally very similar to phosphate, but the new research shows that certain proteins responsible for importing phosphate are unable to handle arsenate’s slightly larger size, which warps a key hydrogen bond, allowing certain bacterial species grow in high-arsenate environments.
The findings “show how a gatekeeper [protein] keeps arsenate out [of bacteria], so levels don’t accumulate and the bacteria don’t have to worry about toxic effects,” said Ronald Viola, a chemist at the University of Toledo who was not involved in the research.
The study drives a nail in the coffin of a 2010 Science paper in which NASA researchers claimed to have discovered a strain of Halomonas bacteria in Mono Lake, California, that incorporated arsenate, instead of phosphate, into its DNA backbone. The study generated a stir in the scientific community, drawing much press and criticism. The findings were subsequently refuted by several studies, though the paper has not been retracted.
The new work provides a mechanistic explanation for how the bacteria in Mono Lake glean enough phosphate from their environment to grow, despite the high levels of arsenate in the water. Phosphate is essential to life, being incorporated into cells’ key energy molecule, adenosine tri-phosphate (ATP), and the DNA backbone. While arsenate is similar in size and structure to phosphate, its compounds are much less stable. As a result, if the enzymes incorporate arsenate into ATP, for example, it will result in a “futile” cycle, explained first author Mikael Elias of the Weizmann Institute of Science in Israel—the cell gets no energy from its efforts because the arsenate-based molecule quickly degrades.
After last year’s controversial study claimed to refute this dogma, Elias and study lead Daniel Tawfik began investigating strategies bacteria use to avoid making this mistake. The researchers turned to phosphate-binding proteins that are part of the transport chain bacteria use to import phosphate from the environment. They cloned phosphate-binding proteins (PBPs) from different species of bacteria, including one from Pseudomonas fluorescens, which are killed by high levels of arsenate, and two from GFAJ-1, the arsenate-tolerate strain from Mono Lake. They then tested the ability of the various PBPs to discriminate between phosphate and arsenate, finding that most had a 500- to 850-higher fold selectivity for phosphate. Even more impressive, GFAJ-1’s PBP-2, which is upregulated in low-phosphate conditions, showed 4,500-fold selectivity for phosphate over arsenate. This extreme selectively presumably allows GFAJ-1 bacteria survive in high-arsenate conditions by binding only phosphate, rare as it may be.
The next step, said Elias, was to figure out how the PBPs distinguish between arsenate and phosphate. Arsenate is only about 4 percent bigger than phosphate by volume, which is one reason some proteins find it difficult to distinguish between the two, Elias explained. X-ray crystallography showed that the PBP from P. fluorescens bound the two molecules with only subtle differences—differences Elias would have missed if his crystallography data hadn’t achieved sub-angstrom resolution. But in the detailed images, the researchers could see that, compared to phosphate, arsenate threw one of the 12 hydrogen bonds in the binding pocket out of alignment.“In hydrogen bonds, the binding angles are very important,” explained Elias, who added that this strategy for discriminating between ions like arsenate and phosphate is “unprecedented to my knowledge.”
“The differences in the bond angles are really quite small, but for good catalytic activity, we know bond angles need to be exquisitely aligned, and it appears to be the same for binding proteins,” said Ken Scott, a molecular biologist at the University of Auckland in New Zealand who was not involved in the research.
The implications of the research are two-fold, said Elias. First, of course, it complements what’s known about how bacteria resist arsenate toxicity: “If the poison is outside, the first level of resistance is not to take it in.” Second, Elias is excited about the potential for applying this discrimination strategy to synthetic biology, perhaps allowing scientists to avoid side-effects by designing drugs with high binding selectivity to the appropriate targets.
Furthermore, this work, as well as the spate of papers providing contradictory evidence to the initial Science paper on the Mono Lake bacteria, demonstrates that “science is working the way it’s supposed to work,” said Viola. “You have an observation, come up with a hypothesis, and test it.”
Tomado de/Taken from The Scientist
Resumen de la publicación/Abstract of the paper
The molecular basis of phosphate discrimination in arsenate-rich environments
M Elias, A Wellner, K Goldin-Azulay, E Chabriere, JA Vorholt, TJ Erb and DS Tawfik
Nature (2012) doi:10.1038/nature11517
Published online 03 October 2012
Abstract
Arsenate and phosphate are abundant on Earth and have striking similarities: nearly identical pKa values, similarly charged oxygen atoms, and thermochemical radii that differ by only 4%. Phosphate is indispensable and arsenate is toxic, but this extensive similarity raises the question whether arsenate may substitute for phosphate in certain niches. However, whether it is used or excluded, discriminating phosphate from arsenate is a paramount challenge. Enzymes that utilize phosphate, for example, have the same binding mode and kinetic parameters as arsenate, and the latter’s presence therefore decouples metabolism. Can proteins discriminate between these two anions, and how would they do so? In particular, cellular phosphate uptake systems face a challenge in arsenate-rich environments. Here we describe a molecular mechanism for this process. We examined the periplasmic phosphate-binding proteins (PBPs) of the ABC-type transport system that mediates phosphate uptake into bacterial cells, including two PBPs from the arsenate-rich Mono Lake Halomonas strain GFAJ-1. All PBPs tested are capable of discriminating phosphate over arsenate at least 500-fold. The exception is one of the PBPs of GFAJ-1 that shows roughly 4,500-fold discrimination and its gene is highly expressed under phosphate-limiting conditions. Sub-ångström-resolution structures of Pseudomonas fluorescens PBP with both arsenate and phosphate show a unique mode of binding that mediates discrimination. An extensive network of dipole–anion interactions, and of repulsive interactions, results in the 4% larger arsenate distorting a unique low-barrier hydrogen bond. These features enable the phosphate transport system to bind phosphate selectively over arsenate (at least 103 excess) even in highly arsenate-rich environments.
Suscribirse a:
Enviar comentarios (Atom)

No hay comentarios:
Publicar un comentario